为什么病毒喜寒怕热?
最近,全国人民都被那个“新型冠状病毒”搅得很不舒服。对于这个“新型冠状病毒”的性质,各种媒体都引用专家的话说,这个新型冠状病毒与SARS病毒一样,都是喜寒怕热的。但是,为什么它们喜寒怕热?好像没有什么人来解释,本文就来说说这个为什么。
这个新型冠状病毒是喜寒怕热的,SARS病毒也是如此,其实,所有的病毒都是喜寒怕热的。为什么大家不说这个“为什么”?我看这里面有一层窗户纸,窗户纸一捅开,问题就很容易理解。但是,要捅开这层窗户纸,我们还是要从头说起。
病毒的结构是什么?病毒的中间是一个遗传物质即一个核酸分子,DNA 或者 RNA,外面是一些蛋白质分子。病毒只有找到了宿主,在宿主细胞内才可以复制自己。离开了宿主,单独的病毒不是生命,它不能单独自我复制。说的略微详细一点:病毒没有自己的代谢机构,没有酶系统,单独的病毒就是没有任何生命活动、也不能独立自我繁殖的化学物质。简单地说,离开了宿主的病毒只是一些不能自我复制的化学意义上的分子。
说到这一步,在化学家看来就是一个非常简单的问题了:温度升高不利于分子的稳定性。
为什么温度的升高不利于分子的稳定存在?
众所周知,分子是由原子构成的。原子为什么能够构成分子?因为在有些原子之间有相互作用。有些相互作用比较强,它们能够使得原子之间形成共价键。比如,氢分子是由两个氢原子组成的体系,这个体系有两个氢原子核(即质子)和两个电子构成。两个质子相互排斥,两个电子也相互排斥,电子与质子之间却相互吸引。在它们之间的这些相互作用下,根据量子力学,可以计算得到这个体系的能量与两个原子核之间距离(核间距)有下图所示的关系:
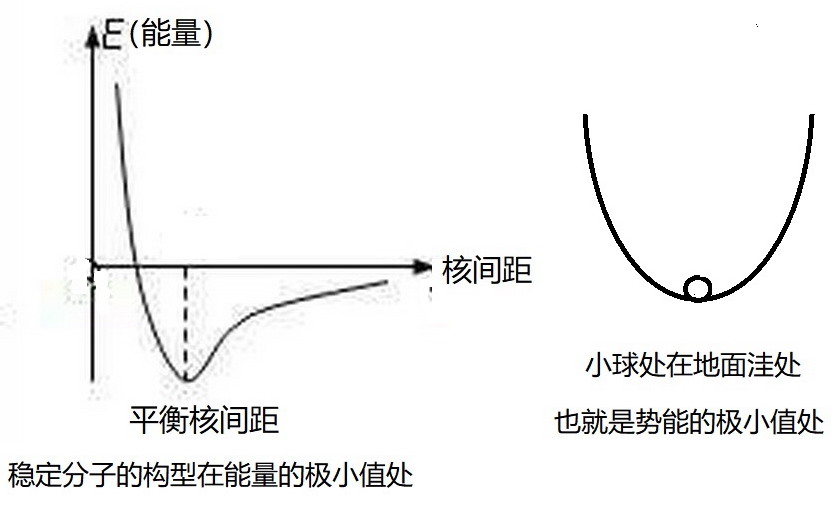
我们把两个原子核相距很远时(即独立的两个氢原子)体系的相对能量设为能量的零点,从图中可见,当两个原子核靠近时。体系能量降低,但是,当两个原子核靠得很近时,体系的能量又迅速增高。在图中所示的“平衡核间距”处,体系的能量最低。核间距大于或小于平衡核间距都将使体系的能量升高,从而处于不稳定状态。这就像在洼处的小球,只有在洼底才能够平衡,离开洼底就不会平衡,会自动滚回底部。
氢分子的平衡核间距约为0.074纳米,在那里,氢分子的能量最低,从而体系最稳定。图中虚线的长度表示氢分子与两个独立的氢原子的能量差,就是两个氢原子形成共价键的键能。这也就是氢分子的稳定化能。正是因为氢分子比两个单独的氢原子能量低,氢分子才能够稳定存在。
但是,原子本身有动能,它要“自由行动”,要离开这个“平衡核间距”。但是,稳定化能的存在,就会把离开平衡核间距的氢原子拉回到平衡核间距。于是,通常情况下,氢原子就在平衡核间距附近做振动。
就像落到坑中的小球,在坑底作振动一样。显然,如果坑比较浅,而小球的动能比较大,小球就有可能跑到坑外去。
同样,如果分子的稳定化能比较小,而原子的动能比较大,原子就可能挣脱稳定化能的束缚,离开分子,这时候,分子就被解离了。
显然,分子的稳定化能越大,这个分子越稳定。而原子的动能越大,就越能破坏分子的稳定。这是矛盾的两个方面。
原子的动能大是什么意思?从宏观上看,就是由这些原子组成的体系的温度高。温度所表示的就是组成体系的原子的平均动能。
上面说过,原子的动能越大,就越能破坏分子的稳定,也就是说,体系的温度越高,分子的稳定性越差。在较高的温度下,分子容易解离。
有人要问,既然温度越高,分子的稳定性越差,那我们怎么没有感觉到因为温度升高,氧气、水、石头等常见的物质分解掉或者变质了呢?这是因为组成这些物质的分子都是非常稳定的分子。组成这些分子的原子之间形成的共价键非常牢固。拿上面所说的氢分子来说,它的键能(也就是把它拉断所需要的能量)是217kJ/mol。按照上面图上的“坑”这样的说法,这是一口非常深的“井”,需要非常大的动能才能够跳出这口井。也就是说,用加热升高温度的办法解离氢分子是非常困难的。在2000K的高温下,只有大约千分之一的氢分子会解离,3000K的高温下也只有不到百分之十发生解离。我们身边常见的水、氧气、石头等都是经由类似的共价键结合的。这些都是很稳定的分子。